
Глава 2. Минеральное питание грибов
Для питания, т. е. для основного обмена грибов, необходимо приблизительно 17-18 элементов, в число которых входят азот, углерод, кислород, водород, сера, фосфор, калий, магний, железо, медь, цинк, марганец, молибден, кальций. Вероятно, им также нужно немного кобальта, а по некоторым данным, и галлий, бор, скандий, ванадий. В специальных синтезах (экологического значения) участвует также хлор, например в синтезе хлорсодержащих антибиотиков гризеофульвина и геодина. Возможно, что роль его и более широка.
В большом количестве грибам требуются следующие основные элементы: азот, углерод, кислород, водород, фосфор, калий, сера и магний. Поэтому в питательные среды на водопроводной воде, где достаточно микроэлементов, добавляют кроме источников азота и углерода только фосфорнокислый калий и сернокислый магний (источники калия, фосфора, серы и магния).
Методы изучения потребностей грибов в минеральных компонентах специально разработаны рядом авторов (Lilly, 1965).
Классический метод (разработан Стейнбергом) состоит в испытании на синтетической среде, очищенной от следов минеральных компонентов, с точной их дозировкой. Учет потребности в них производится в основном по интенсивности роста организма.
Функциональный метод состоит в определении элементов, необходимых для функции определенных энзимов. Исследуется способность этих элементов образовывать комплексы с энзиматическими белками, например, при использовании метода парамагнитной электронно-резонансной спектроскопии (Nicholas et al., 1962) изучалось образование белковых комплексов у бактерий с железом, марганцем, молибденом и медью.
В работах с минеральными компонентами необходимо учитывать два момента.
1. Возможность биологического замещения одного компонента другим. Полное замещение встречается редко, но частичное наблюдалось. Таким образом, можно не выявить потребность в элементе, если в среде есть его заместитель. Например, в питании Allomyces arbuscula (штамм Burman IDb) кальций можно полностью заменить хромом, стронцием, но стронция требуется в 10 раз больше, чем кальция (Lilly, 1965).
Аналогичное явление отмечено для замены цинка при синтезе протеинов, триптофана и других ароматических аминокислот через кадмий у Aspergillus niger (Bertrand, De Wolf, 1960). Калий частично замещается у A. niger натрием.
2. Возможность антагонизма ионов. Концентрация необходимого иона может зависеть от концентрации другого иона. Например, для Saccharomyces carlsbergiensis при увеличении концентрации натрия в среде нужно увеличивать и концентрацию калия для получения оптимальных условий роста. В результате увеличения концентрации натрия уменьшается усвояемость калия.
Накопление кобальта и никеля в клетках Torula (Candida) зависит от концентрации в среде магния (Lilly, 1965).
По требуемым количествам элементы питания делят на макроэлементы и микроэлементы. После азота, углерода, водорода, кислорода наиболее важные макроэлементы - фосфор и сера. Они участвуют почти во всех биохимических реакциях в живых организмах как энергодающие системы или акцепторы в процессах биосинтеза (при конденсации, циклизации, окислении, восстановлении и т. д., являясь компонентами коферментов).
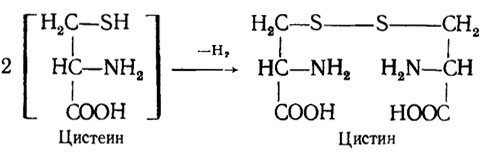
Сера играет большую роль в структуре клеток, так как она входит в состав белков в виде серосодержащих аминокислот: цистина, метионина и др. Сера обеспечивает конформацию, т. е. пространственную конфигурацию ферментных белков, связывая части полипептидной цепи -S-S-мостиками. Она входит в состав очень реактивных сульфгидрильных соединений (содержащих свободную SH-группу), являющихся источниками водорода при восстановительных реакциях. Тип их трансформации можно видеть на примере превращения цистеина в цистин:
Так же функционирует трипептид-глютатион, составленный из глютаминовой кислоты, глицина и цистеина: 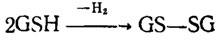
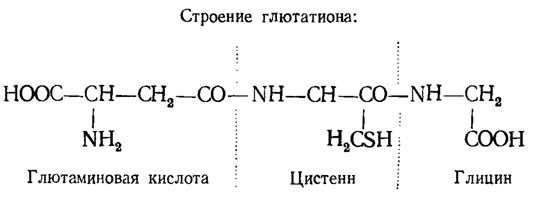
Другая функция серы состоит в стимуляции протеолитических ферментов, а отсюда и участие сульфгидрильных соединений в делении клеток. Поэтому SH-соединений много в молодых клетках. По некоторым данным, старение белков зависит от понижения их реактивности вследствие образования обильных мостиков дисульфида -S-S-, тогда как активная форма содержит SH-группы. Сера входит в состав ряда витаминов: тиамина, биотина и коэнзима А, участвующего в обмене кислот цикла Кребса, жирных кислот, липоидов и терпенов. Почти все реакции конденсации с присоединением двууглеродных фрагментов идут с участием КоА.
SH-группы являются необходимыми коферментами очень большого количества энзимов, чаще оксидаз, дегидрогеназ и гидратаз, присоединяющих воду (табл. 2.1). Часто функция SH-группы состоит в удерживании субстрата реакции в контакте с производящим реакцию коферментом (например, витамином) или в фиксации кофермента на апоферменте.

Таблица 2.1. Извлекаемые из грибов ферменты, содержащие SH-группы (Диксон, Уэбб, 1982)
Примечание. М2+ и М+ - двух- и одновалентные металлы.
Сера в грибах (и в других организмах) в подавляющем числе случаев находится в восстановленной форме как производное сероводорода Н-S-Н, но источником ее могут служить только окисленные соединения (ионы SО42- и SO32-), далее восстанавливаемые грибами. Сульфиды металлов (FeS, Na2S), как правило, непригодны для питания грибов. Исключение составляет Ceratostomella multiannulata (Ophiostoma multiannulatum), не усваивающая сульфатов, а только сульфид аммония, цистин и цистеин (Лилли, Барнетт, 1953) и сапролегнии, нуждающиеся в серосодержащих аминокислотах. По Волконскому (Фостер, 1950), они относятся к паратиотрофам, а усваивающие сульфаты - к эутиотрофам. Сера требуется при добавлении ее в питательные среды в сотых или тысячных долях процента, но количество ее в клетках меняется в зависимости от ее концентрации в среде и от концентрации азота (так как она входит в состав белков) и может колебаться от 0,1 до 0,5% от массы сухого мицелия (Lilly, 1965).
Фосфор входит в виде ортофосфорной кислоты в нуклеопротеиды, функцией которых является передача наследственных свойств и синтез белков. В связи с этим он необходим всем живым организмам. В табл. 2.2 представлены обнаруживаемые у грибов содержащие фосфор нуклеопротеиды.

Таблица 2.2. Нуклеотиды, обнаруживаемые в кислоторастворимой (в холодной хлорной или трихлоруксусной кислотах) фракции Penicillium chrysogenum или Agaricus bisporus
Примечание. Обозначения в списке сокращений. ГМФ - нофосфат, гуанозинмонофосфат.
Накопление нуклеотидов в мицелии грибов соответствует преобладающему у данного вида или в данной фазе развития обмену. Например, у хитинообразующих грибов обилен уридинфосфатацетилглюкозамин (УДФАГ) в богатых жиром склероциях спорыньи (Claviceps purpurea) - цитидинфосфат, у дрожжей и в молодом мицелии Penicillium chrysogenum - АТФ (Белозерский, Кулаев, 1964; Крицкий, 1965; Мансурова, 1966). Датчиками энергии фосфорных связей обычно являются трифосфаты нуклеотидов (реже дифосфаты), но у грибов как источники энергии (связи -О-Р-) еще широко используются неорганические полифосфаты, описанные в первой главе, накапливающиеся в мицелии иногда в очень большом количестве (Кулаев, 1975).
Фосфат является также обязательной составной частью большинства кофакторов окислительных, восстановительных, гидролитических и декарбоксилирующих коферментов, например НАД и НАДФ. Хотя роль фосфора как непосредственного кофактора ферментов кажется незначительной (табл. 2.3), однако почти ни одна ферментная реакция не обходится без фосфора как донора энергии. Весь обмен углеводов идет при обязательном фосфорилировании всех видов Сахаров от триоз до седогептулозы, с присоединением от одной до двух молекул фосфорной кислоты, например, глюкозо-6-фосфат, фруктозо-1,6-дифосфат и т. д. С участием фосфорилирования протекают все процессы брожения и дыхания.
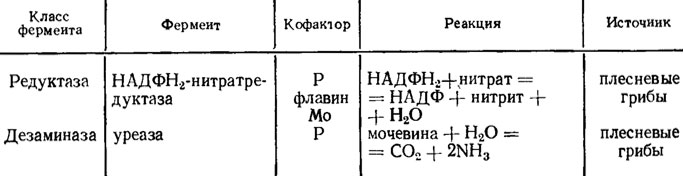
Таблица 2.3. Извлекаемые из грибов ферменты, активируемые фосфором (по Диксону и Уэббу, 1982)
Вместе с азотсодержащим спиртом и жирными кислотами фосфор входит в состав фосфолипидов и других эфиров, например фитина (фосфорного эфира инозита).
Фосфор усваивается грибами в виде РO42-, органических фосфатов и фосфатэфиров и требуется при введении в питательную среду в количестве от 0,1 до 0,2%. Некоторые грибы, например растущий на среде с целлобиозой Merulius (Serpula) lacrymans, предпочитают органические фосфаты неорганическому ортофосфату. Содержание фосфора в грибах меняется в зависимости от возраста: в спорах и в молодом мицелии его всегда больше, чем в старом. Например, у Aspergillus niger на третий день культивирования его содержится 12,7 мкг на 1 мг массы сухого мицелия, а на девятый день - 2,4 мкг/мг (Lilly, 1965).
Близкие к этим данным были получены нами (Беккер, Дмитриева и др., 1972) для культивируемого на среде с кукурузным экстрактом и глюкозой A. fumigatus, где общее количество определявшихся фосфорных соединений достигало 22-25 мкг/мг сухой массы мицелия (или 2,2-2,5%). При этом порядка 20-25% от их количества составляли кислоторастворимые полифосфаты, 4-5% - свободные нуклеотиды и около 70% - РНК. Количество ДНК не превышало 7-9% от общего количества определяемых фосфорных соединений, а соотношение между РНК и ДНК составляло почти целый порядок (РНК было в 7-8 раз больше, чем ДНК (табл. 2.4).
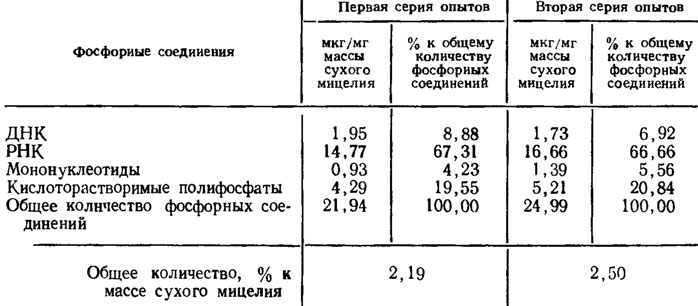
Таблица 2.4. Количество фосфорных соединений в мицелии Aspergillus fumigatus из трехдневной культуры на качалке на среде с кукурузным экстрактом и глюкозой (по Беккер, Дмитриевой и др., 1972)
Для дрожжей указываются еще большие отличия в их концентрациях, а именно отношение ДНК: РНК составляло 1:50, а общая концентрация нуклеиновых кислот в ядре не превышала 10% от общего количества в мицелии. Такое высокое преобладание РНК над ДНК в клетке является, видимо, характерным для вегетативных форм роста очень многих грибов и отличает их от других организмов.
Калий требуется грибам в количествах, соизмеримых с фосфором (от 40 до 150 мг на литр среды), поэтому в питательных средах они дозируются вместе в виде фосфата калия. Калий весьма специфичен и заменяется натрием и бериллием только частично. Он активирует ряд ферментов (табл. 2.5).

Таблица 2.5. Извлекаемые из грибов ферменты, активируемые ионом калия (Диксон, Уэбб, 1982)
Из объективных данных можно заключить, что при недостатке калия у Aspergillus niger образуется много щавелевой кислоты, т. е. происходит неполное окисление и выделяется NH3 вследствие торможения синтеза или аминирования органических кислот и отсюда торможения синтеза белка. При достаточном количестве калия и недостатке витамина B1 происходит торможение декарбоксилирования продуктов углеводного обмена и накапливается пировиноградная кислота, следовательно, калий участвует в синтезе кетокислот (Lilly, 1965). Механизм действия калия на обмен углерода стал выясняться при изучении его роли в проницаемости и усвоении минеральных компонентов среды и в поддержке в клетке изменяющегося при дыхании и брожении нормального баланса ионов, особенно концентрации Н+.
Оказалось, что К+, Na+ и Н+ имеют одинаковый переносчик через мембрану, но сродство этого переносчика к натрию в 20-25 раз ниже, чем к калию, что и объясняет незаменимость калия в обмене. В отсутствие К+ (компенсатора) концентрация Н+-ионов в клетке должна повышаться до непереносимого белками плазмы предела вследствие накопления кислых продуктов дыхания и брожения и всасывания анионов, прежде всего Н2РО4-. Отсюда компенсация понижения рН при недостатке калия осуществляется в форме выделения NH3.
Сбалансированное усвоение организмами калия и фосфора объясняется тем, что фосфорная кислота в клетке ведет себя как обменная система анионов Н2РО4- и ОН-. При усвоении ее среда подщелачивается, а клеточное содержимое подкисляется. Однако К+ способен входить в клетку наравне с Н+ и в 5 раз быстрее других катионов, но обратное вытекание его из клетки в 30 раз меньше, чем Н+ (из клетки способно выделяться 20 мкмоль/кг/ч К+ против 600 мкмоль/кг/ч для Н+). Поэтому концентрация калия в клетке (при рН 6,0) может достигать 200 мкмоль/кг, а Н+ только 0,001 мкмоль/кг и вытекание Н+ из клетки при этом не прекращается.
Таким образом, К+ всасывается из среды избирательно, даже когда внутренняя концентрация его в 5000 раз больше наружной. Натрий всасывается в 20 раз слабее калия, а выделяется намного быстрее.
Следовательно, калий непосредственно не участвует (Rothstein, 1965) в реакциях метаболизма, как микроэлементы и сера, в их энергетическом снабжении, как фосфор, или в композиции клеточных структур, как азот, кислород, водород и углерод. Его функция состоит в конструировании механизма обмена с внешней средой и в поддержании нормальных для обмена физико-химических условий rН, рН, баланса ионов в клетке.
Магний очень необходимый элемент. Потребность в нем близка к потребности в сере, что является обоснованием для применения его в средах в виде MgSO4. Aspergillus niger требуется для оптимального роста 20 мг/л Mg2+, Allomyces arbuscula - 9 мг/л.
Содержание магния в мицелии зависит от возраста культуры и типа источника азота. Так, клетки трехдневной культуры мицелия A. niger на среде с аммонийным азотом содержали 0,13%, а с нитратным - 0,26% магния (Lilly, 1965). Можно искусственно обогатить мицелий магнием на богатой им среде.
В дрожжах концентрация магния достигает 292 мкг/кг сырых клеток, но они плохо растут без достаточного количества калия в среде. Эти соотношения объясняются значением калия для усвоения Н2РO4- и ролью магния в фосфорилировании. Магний является составной частью (кофактором) фосфатаз. Внешне это проявляется в согласованном усвоении обоих элементов: на каждые 36 атомов фосфора требуется 1 атом магния.
Магний играет большую роль в углеводном обмене и всех синтезах на основе использования энергии фосфорных связей. Около 50 ферментативных реакций у грибов идут с участием магния. Так, 18 фосфокиназ осуществляют фосфорилирование и перенос энергии фосфорных связей с одного соединения на другое, 16 трансфераз осуществляют с помощью энергии фосфорных связей синтезы с переносом углеродсодержащих фрагментов с одного соединения на другое. Ряд фосфатаз производят отщепление Н2РO4-, ряд синтетаз осуществляют конденсацию с участием фосфорилирования. Другие ферменты также действуют при участии магния (мутазы, изомеразы, лиазы и редуктазы) (Диксон, Уэбб, 1982).
В синтетазах магний участвует преимущественно совместно с калием. По-видимому, все же не все фосфатазы связаны именно с магнием, так как, например, он активирует у Penicilllum chrysogenum ферменты, деполимеризующие мета-, пирофосфаты, АТФ при рН 6 и подавляет их при рН 3,5. С другой стороны, он возвращает активность фосфатазам, инактивированным цианидом (Sadasivan, 1965).
На пектиновые энзимы он влияет также различно в зависимости от оптимума их рН, подавляя энзимы Botrytis cinerea с оптимальным рН 4-5 и активируя энзимы Pythium debarianum с оптимальным рН 8-9 (Ashour, 1954). Магний способен нейтрализовать действие ряда ядов (сулемы, борной кислоты) возможно вследствие антагонизма ионов. Магний сильно угнетает одни биосинтезы биологически активных веществ (например, токсинов уровской болезни у Fusarium sporotrichiella var. роае - представляющих собой стероиды или трихотецины) и стимулирует другие (например, образование янтинеллина у P. janthinellum (Беккер, 1963).
Кальций в золе грибов содержится от нескольких единиц до 50%. Особенно часто он встречается в виде щавелевокислого кальция, например в мицелии Merulius (Serpula) Iacrymans. Нередко кальций играет роль нейтрализатора избытка органических кислот, образующихся в обмене многих грибов. В отсутствие его урожай мицелия Aspergillus niger и Fusarium снижается. У некоторых водных форм грибов, например у Allomyces arbuscula, он принадлежит к числу обязательных элементов (Lilly, 1965) и участвует в транспорте аминокислот. Ион Са2+ является также необходимым элементом для роста оомицета Phytophthora infestans, оптимально эффективным в концентрации от 50 до 500 мкМ (Окороков и др., 1976) (рис. 2.1). Специфичным переносчиком Са2+ в мицелии и донором энергии оказалась магниевая соль пирофосфата (РРн), тогда как магниевые соли АТФ и полифосфатов (ПФn) ингибировали этот процесс (рис. 2.2; Сысуев, 1979). Неорганический фосфат не проявлял действия (Okorokov et al., 1978), Участвующая в освобождении энергии для переноса Са2+ в клетку пирофосфатаза теряла активность при избыточном введении ионов Са2+ в среду при инкубации in vitro (выше 5 мкМ), что должно вести к прекращению транспорта этого элемента в клетку (Сысуев и др., 1977; Сысуев, 1979). Оптимальная доза Са2+ для роста Phytophthora infestans находится в пределах от 50 до 500 мкМ на грамм сухого мицелия, что составляет порядка от 0,2 до 2 мг на 1 литр культуральной среды. Роль иона кальция для метаболизма P. infestans в этих работах осталась не вполне ясной. Наблюдаемой в присутствии Са у другого оомицета Achlya стимуляции транспорта аминокислот установить не удалось у Phytophthora (Сысуев и др., 1977). Возможно, что Са замешан в функции проницаемости клеточных мембран этого гриба.
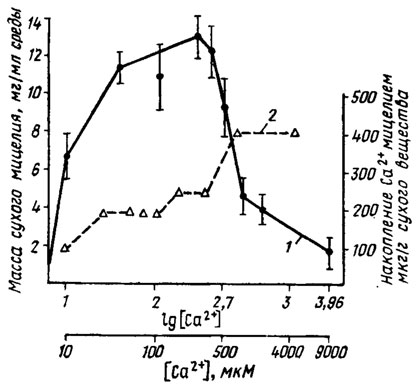
Рис 2.1. Влияние концентрации кальция на рост Phytophthora infestans. 1 - масса сухого мицелия; 2 - накопление в нем Са2+ (Сысуев, 1979)
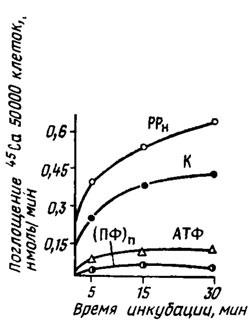
Рис. 2.2 Влияние Mg2+ - АТФ (10 мкМ). Mg2- РРн (10 мкМ) и Mg2+ (ПФ) (1 мкМ) на поглощение 45Са (1 мкМ) проростками Phituphthora infestans; К - контроль (Сысуев 1979)
Кальций является составной частью (коферментом) ряда гидролаз (табл. 2.6), например а-амилазы и некоторых гидролаз циклических полисахаридов (Диксон, Уэбб, 1982). Вероятно, в силу конкуренции с магнием кальций может подавлять активность некоторых фосфатаз у Penicillium chrysogenum (Sadasivan, 1965).
Микроэлементы (или следовые элементы) необходимы для обмена в незначительных количествах (тысячных и десятитысячных долях процента, по Стайнбергу, от 0,3 до 0,02 мг/л). К ним относятся железо, цинк, медь, марганец, молибден, кобальт, бор и некоторые другие (для грибов также галлий, скандий). Они входят в состав ферментов. Для изучения потребности в микроэлементах у грибов большую роль сыграли работы Стайнберга (1919), исследовавшего ее на модели Aspergillus niger.

Таблица 2.6. Извлекаемые из грибов гидролитические ферменты, содержащие Са2+ (Диксон, Уэбб, 1982)
Железо - микроэлемент, требующийся в наибольшем количестве (0,001%), его даже добавляют в среды на водопроводной воде, например в среду Чапека. На среде без железа урожай A. niger снижается в 70 раз. Усваивается железо в основном в форме растворимых неорганических солей (сульфатов и хлоридов), но некоторые грибы удовлетворяются хелатами железа органического происхождения (гемы, цитохромы и другие), например Pilobolus (Page, 1962, цит. по Lilly, 1965). Железо входит в состав ряда важных окислительных ферментов со структурой порфиринов, особенно участвующих в дыхательной цепи и цикле Кребса (табл. 2.7).

Таблица 2.7. Извлекаемые из грибов оксигеназы, гидратазы и дегидрогеназы, активируемые Fe2+ (Диксон, Уэбб, 1982)
К числу ферментов, содержащих железо как кофактор, относят каталазу, пероксилазу, цитохромы бис, цитохромоксидазу и цитохромпероксидазу, но, кроме того, оно активирует ряд других ферментов. Механизм участия железа в окислительных реакциях представляют обычно следующим образом: Fe2+ - е¯ ↔Fе3+ + е¯. Сброс электрона с двухвалентного железа сопровождается выделением энергии. Специфическое влияние железа на обмен A. niger состоит в усилении процессов окисления: при дефиците железа образуется больше лимонной кислоты и меньше щавелевой, т. е. в присутствии его достигается более высокая степень окисления. Ввиду того что железо играет роль в некоторых этапах восстановления нитратов, в присутствии его в достаточных количествах некоторые грибы усваивают помимо обычного для них иона NH4+ еще и ион NO3-.
Кроме того, ионы железа обладают способностью резко усиливать активность некоторых антибиотиков, например ликомаразмина у Fusarium oxysporum f. lycopersici. Однако все случаи участия железа в обмене не полностью обосновывают высокую потребность в нем. Более детальный анализ показал, что в окислительных ферментах участвует не более 20% требующегося для нормального обмена количества железа.
До 80% железа оказалось содержащимся в клетках в форме неорганических комплексов с фосфорной кислотой (Кулаев, 1975). Эти соединения, видимо, представляют собой механизм депонирования и детоксикации отщепляющегося при синтезах ортофосфата. Этот механизм может быть основой для объяснения сходства симптомов хлороза (недостаток железа) и паразитарных токсикозов растений (тоже хлороз), при которых наблюдается как разобщение окислительного фосфорилирования (сброс Н3РО4 без обратного включения в АТФ), так и хелирование железа токсинами паразитов (тогда хлороз является результатом накопления не связанной с железом фосфорной кислоты).
Физиологическое действие металлов часто резко возрастает при их сочетании. Эффект действия на грибы железа сильно возрастает в присутствии цинка. В опытах Стейнберга масса сухого мицелия Aspergillus niger без железа и цинка была равна 18 мг, в присутствии одного железа - 44, одного цинка - 40, в присутствии железа и цинка - 731 мг вместо 44 + 40 = 84 мг, если бы эффекты этих микроэлементов просто складывались. Это можно связать с последовательным участием обоих элементов в ферментах дыхательной цепи (в первых ступенях ее - цинк, в последующих - железо).
Оба этих элемента участвуют также в активизации пектиновых энзимов у возбудителя вилта хлопчатника Fusarium oxysporum f. vasinfectum, для которого оптимальная концентрация железа составляет 20-40 мг/кг почвы (при тех же концентрациях магния), а оптимальная дозировка цинка 20 мг/кг почвы (Sadasivan, 1965).
Цинк необходим для очень многих обменных процессов. Потребность в нем доказана для ряда видов Aspergillus, дрожжей, мукоровых грибов, например Rhizopus nigricans, и других зиго- и оомицетов, для ряда сумчатых грибов, патогенных грибов, возбудителей дерматомикозов и т. д. Основная роль цинка как кофактора дегидрогеназ, участвующих в углеводном обмене (табл. 2.8), демонстрируется его влиянием на экономический коэффициент (на увеличение массы сухого мицелия, отнесенного к весу использованных углеводов) и на увеличение выделения СO2 (на повышение энергии дыхания).
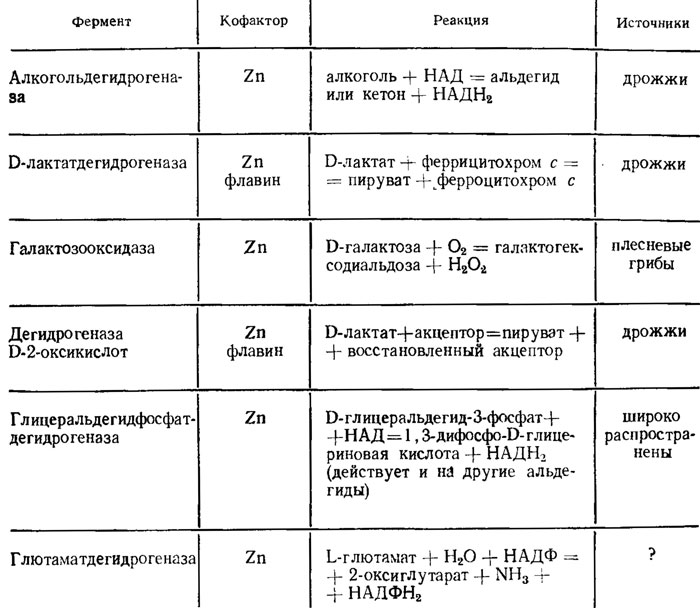
Таблица 2.8. Извлекаемые из грибов дегидрогеназы, содержащие Zn2+ (Диксон, Уэбб, 1982)
При недостатке цинка окисление субстрата идет не полностью и в среде получается много побочных продуктов обмена, например органических кислот. В присутствии цинка их образование подавляется. Если источником углерода являются органические кислоты - винная, янтарная, глюконовая и т. д., то влияние дефицита цинка проявляется много слабее, что объясняется его участием в цикле дикарбоновых кислот Кребса. Цинк участвует в образовании, вовлечении в дальнейший обмен и превращении в аминокислоты многих окси- и кетокислот.
Образование фумаровой и молочной кислот у Rhizopus снижается при повышении концентрации цинка, что объясняется его участием как кофермента в дегидрогеназах молочной кислоты, D-2-оксикислот, а также алкоголя, глицеральдегида и т. д. (см. табл. 2.8). Специфичная необходимость цинка для обмена была показана при попытке замены его химически близким кадмием, который мог пополнить дефицит его только при наличии в среде не менее 25 мкг/л исходного количества цинка, и оптимальное количество кадмия на этом фоне (450 мкг/л) почти вдвое превышала оптимальное количество цинка (250 мкг/л), требуемое в этих условиях (Bertrand, de Wolf, 1961).
Специфический эффект цинка в отношении синтеза у Aspergillus niger аминокислот оказался наиболее выраженным для ароматических аминокислот с бензольным ядром: в первую очередь фенилаланина, а затем триптофана и тирозина, причем замена цинка в этом синтезе кадмием была возможна только для триптофана и тирозина.
Подавление триптофансинтетазы при цинковом голодании была показано для Neurospora. При недостатке цинка у A. niger подавляется (хотя возможно вторично, в результате угнетения обмена углеводов) и синтез алифатических аминокислот - аланина, глицина, пролина, треонина, серина, валина, лейцина, изолейцина, аспарагиновой и глутаминовой кислот.
Влияние цинка на углеводный обмен A. niger сказывается и на синтезе нуклеиновых кислот, в котором в первую очередь, вероятно, страдает биосинтез рибозы и дезоксирибозы. Для них замена цинка через кадмий имеет слабый эффект (Bertrand, de Wolf, 1961). Какие именно из шести известных цинкозависимых энзимов гликолитического и пентозного циклов играют здесь основную роль, сказать трудно. Это могут быть как зависящие от цинка в процессе их синтеза глюкозоизомераза, фосфофруктокиназа и глицеральдегидфосфатдегидрогеназа, так и содержащие цинк в качестве коэнзима глюкозо-6-фосфатдегидрогеназа, 6-фосфоглюконатдегидрогеназа и особенно сильно зависящая от цинка альдолаза.
Участие цинка в образовании многих энзимов объясняется его особой ролью в синтезе их коферментов (ароматические аминокислоты, аминокислоты, НАД и т. д.), что отражается на продуцировании биологически активных веществ и других веществ специального экологического назначения, образующихся в боковых путях обмена. Например, цинк, введенный в концентрациях, в 1000 раз превышающих концентрацию, оптимальную для роста (для роста достаточно 0,001 мг %), резко усиливает образование цитохрома и цитохромоксидазы у Ustilago sphaerogena.
Цинк сильно влияет на образование некоторых токсинов, например токсина уровской болезни (поина) у Fusarium sporotrichiella var. poae и других соединений стероидной структуры (Беккер, 1963). Он влияет на образование фузариевой кислоты у F. oxysporum f. vasinfectum (возбудитель фузариозного вилта хлопчатника), стимулируя его в концентрации около 250 мкг/л и угнетая при 400 мкг/л (рис. 2.3) (Kalyanasundaram, Saraswathi - Devi, 1955).
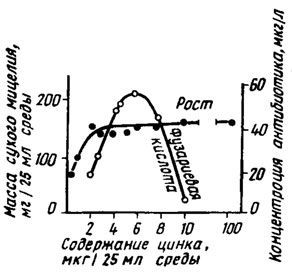
Рис. 2.3. Действие цинка на рост и антибиотическую активность Fusarium oxysporum f. vasinfectum
Действие цинка на формирование способности возбудителя вилта образовывать фузариевую кислоту в онтогенезе культуры проявляется и как селекционирующий фактор. В почве при разной концентрации цинка формируются популяции F. oxysporum, воспроизводящие уровни активности фузариевой кислоты, свойственные исходной культуре при разных концентрациях цинка в питательной среде (рис. 2.4) (Беккер, Полетаева, 1968). Уровень вилтового токсина в хлопчатнике также воспроизводит эту кривую токсичности популяции возбудителя. Сопоставление данных спектрофотометрии пиридинов и активности фузариевой кислоты этих популяций показывает, что увеличение концентрации цинка в почве выше оптимума для синтеза фузариевой кислоты снижает только ее синтез, но продолжает увеличивать способность к образованию нетоксичных соединений этого ряда (Беккер, Полетаева, 1971) (рис. 2.5). Цинк способствует также образованию многих пигментов, например меланина у Macrosporium и хризогенина у Penicillium chrysogenum.
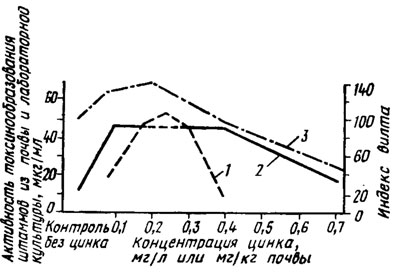
Рис. 2.4. Зависимость образования фузариевой кислоты в лабораторной культуре от концентрации цинка в среде (1), активность штаммов возбудителя вилта, выделенных из почвы с различным содержанием цинка (2), и интенсивность заболевания хлопчатника вилтом (3) на тех же почвах (Беккер, Полетаева, 1971)
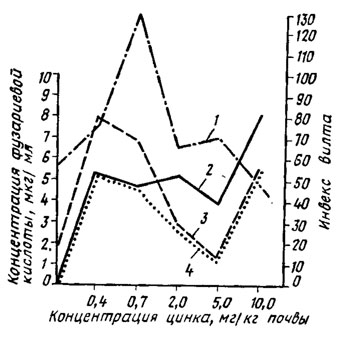
Рис. 2.5. Изменение способности популяций Fusarium oxysporum f. vasinfectum к образованию фузариевой кислоты (4) и других пиридинов, определяемых спектрофотометрическим (2) и биологическим (3) методами, и присущая им интенсивность заболевания (1) при их формировании в почве с различными дозами цинка (Беккер, Полетаева, 1971)
Медь имеет более ограниченное значение, чем железо и цинк, однако и она принадлежит к числу необходимых для грибов микроэлементов. Она требуется Aspergillus niger в количестве порядка 0,4 мг/л. Однако у Nectria galligena рост продолжает усиливаться и. при концентрациях в 10 раз выше. Сильное влияние меди на рост N. galligena объясняется большой ролью ее в обмене тирозиназы (полифенолоксидазы, окисляющей тирозин), присутствующей у многих грибов, особенно у микоризообразующих базидиомицетов. Возможно, что медьсодержащие энзимы этого типа играют у ряда грибов роль в их энергоснабжении.
Кроме тирозиназы медь входит в состав таких оксидаз, как лакказа (полифенолоксидаза), оксидаза аскорбиновой кислоты, оксидаза цитохрома а3, уратоксидаза (табл. 2.9), и участвует в этапах восстановления нитратов на ступенях нитрит- и гипонитритредуктаз (Lilly, 1965). У A. niger она играет роль при образовании и использовании лимонной кислоты (рис. 2.6). При добавлении в среду цитрата его потребность в меди заметно падает.

Таблица 2.9. Извлекаемые из грибов оксидазы, содержащие медь (Диксон, Уэбб, 1982)
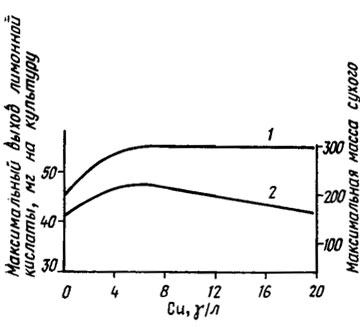
Рис. 2.6. Влияние меди на изменение массы мицелия (1) и содержание лимонной кислоты (2) в культуре Aspergillus niger. Увеличение количества меди в среде выше 6-7 мкг/л приводит к снижению количества лимонной кислоты в культуральной жидкости (Bertrand, de Wolf, 1960)
Как железо и марганец, медь сильно влияет у грибов на спорообразование и пигментацию спор. По этому признаку с помощью A. niger можно обнаружить концентрации меди в среде порядка 0,05 мкг / 50 мл. Медьсодержащие оксидазы, видимо, участвуют также в образовании меланнновых пигментов грибов (табл. 2.9).
Потребность в меди была доказана для A. niger, A. flavus, Rhizopus sp., Sclerotium rolfsii, Cercospora nicotianae, Fusarium oxysporum, Pythium inegulare, Thielavia basicola (Steinberg, 1950). Не исключается, что медьсодержащие оксидазы участвуют также в детоксикации ароматических антисептиков для древесины типа креозота, начиная, таким образом, сукцессию грибов на обработанной ими древесине. Первыми поражают ее грибы, содержащие меланины.
Марганец нужен грибам в очень небольшом количестве порядка 1:109. Однако он играет существенную роль в обмене как кофактор щавелевоуксусной и щавелевоянтарной карбоксилазы - фермента, участвующего в основной реакции усвоения СО2 у гетеротрофов путем присоединения ее к энолпировиноградной кислоте. Общее число обнаруженных у грибов ферментов, где марганец является кофактором (табл. 2.10), невелико, и они главным образом участвуют в трансформации органических кислот цикла Кребса.

Таблица 2.10. Извлекаемые из плесневых грибов дегидрогеназы, редуктазы, дегидратазы и лиазы, содержащие Мn2+ (по Диксону, Уэббу, 1982)
Марганец вместе с медью участвует как кофактор в образовании и потреблении лимонной кислоты у Aspergillus niger и предположительно - в ее синтезе как кофермент аконитазы. Некоторую роль играет марганец и в азотном обмене, активируя аргиназу дрожжей и входя в состав гидроксиламинредуктазы у плесневых грибов (Диксон, Уэбб, 1982). Последний энзим был обнаружен у Neurospora crassa при восстановлении этим организмом гидроксиламина в аммиак (Lilly, 1965).
Марганец специфично угнетает образование пектолитических энзимов у Fusarium oxysporum f. vasinfectum, конкурируя при этом с железом. При соотношении железа и марганца 1:2 образование пектиновых энзимов у этого паразита хлопчатника падает и соответственно снижается вызываемое им заболевание хлопчатника фузариозным вилтом (Sadasivan, 1965).
Молибден требуется грибам в наименьшем количестве по сравнению с другими микроэлементами; обнаружено до сих пор его участие всего в одном метаболическом процессе - восстановлении нитрата в нитрит (первый этап пути восстановления соединений азота осуществляется системой нитратредуктаз). Вероятно, с этим процессом связано участие молибдена в фиксации атмосферного азота у бактерий и сине-зеленых водорослей, в котором играет основную роль система ферментов, названная нитрогеназой (Кретович, 1972). Этим объясняется также, что Aspergillus niger на среде с солями NO3- требует больше молибдена, чем на среде с NH4+. Молибден является коэнзимом нитратредуктазы, что подтверждается реактивирующим эффектом добавки молибдена к нит ратредуктазе A. niger, инактивированной цианидом.
В других этапах пути восстановления NO3- кроме молибдена участвуют медь, железо, марганец:
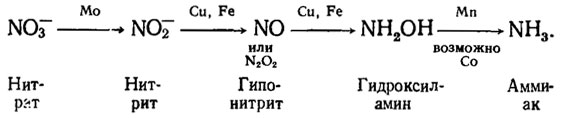
Дефицит молибдена у грибов наблюдается редко, однако он возможен в условиях избытка конкурирующей с этим элементом меди. Наоборот, дефицит меди в результате присутствия избытка молибдена в почве мы наблюдали в Ферганской долине, что отразилось на торможении образования антибиотиков типа геодина у почвенных грибов, антагонистов возбудителя вилта.
Хлор необходим грибам в основном для синтеза хлорсодержащих антибиотиков: геодина (A. terreus), гризеофульвина (Penicillium nigricans, P. urticae и P. janthinellum), хлорсодержащего метаболита калдариомицина (Caldariomyces fumago), нидулина (A. nidulans), налгиолаксина (P. nalgiovensis) (Miller, 1961). Однако у грибов известен один фермент, в составе коферментов которого имеется хлор (табл. 2.11), это арилсульфатаза-эстераза, расщепляющая ароматические эфиры серной кислоты (Диксон, Уэбб, 1982).

Таблица 2.11. Извлекаемые из грибов ферменты, активируемые Мо и Сl- (Диксон, Уэбб, 1982)
Кобальт принадлежит к числу микроэлементов, обязательных для животных и бактерий, участвуя в составе витамина B12 в синтезе метионина и тимидиновой части нуклеотидов ДНК. Выясняется также, что, видимо, он участвует в последнем этапе системы нитратредуктазы (или нитрогеназы), способствуя восстановлению гидроксиламина в аммиак (Ягодин, 1970). Однако необходимость кобальта для грибов пока подтверждена слабо, так как очистить от него среду до уровня, выявляющего его дефицит, пока не удалось, вероятно, вследствие очень малых необходимых количеств кобальта для синтеза ДНК ядер, имеющих у грибов очень малые размеры, особенно в вегетативном мицелии.
Тем не менее существование потребности в витамине B12 у дрожжей (Kloeckera brevis), на которых можно его тестировать, и данные о способности к его синтезу у Aspergillus niger (Lilly, 1965) подтверждают необходимость его для грибов. Для экологии грибов-паразитов существенно, что кобальт усиливает метилирующие системы, в частности накопление переносчика метальных групп, S-аденозилметионина, приводящие к детоксикации фитотоксинов грибов, например фузариевой кислоты при вилте хлопчатника (Полетаева, 1969; Беккер, Полетаева, 1971; рис. 2.7, табл. 2.12).
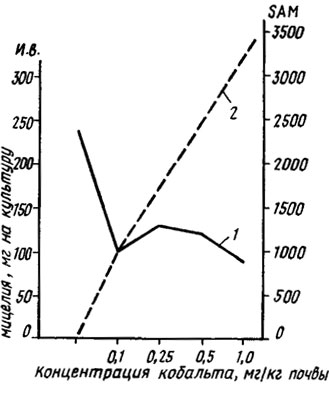
Рис. 2.7. Интенсивность заболевания хлопчатника фузариозным вилтом (и. в. - 1) и накопление в нем переносчика метильных групп S-аденозилметионина (SAM - 2) при различных дозировках кобальта в почве (Беккер, Полетаева, 1971)
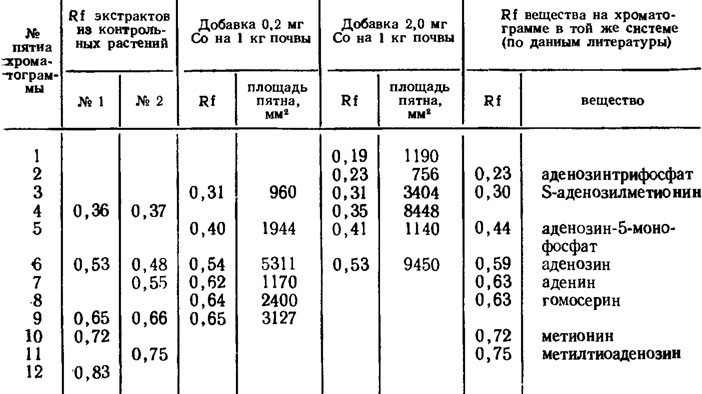
Таблица 2.12. Хроматографический анализ экстрактов 4,5 и НСlO4 из свежих растений хлопчатника, выросших на вилтовом фоне без добавки в почву кобальта (контроль) и с добавкой в нее 0,2 и 2,0 мг/кг СоСl2. Система растворителей: этанол - вода - уксусная кислота (65:34:1). Проявление пятен нингидрином (Беккер, Полетаева, 1971)
По некоторым данным, в определенных условиях у грибов встречается потребность еще в нескольких микроэлементах. Например, галлий по данным Стейнберга стимулирует рост A. niger при добавлении его в количестве 0,02 мг/л, 76 других испытанных микроэлементов не заменяли его.
Скандий оказался необходимым для A. niger при росте его на глицерине как источнике углерода, но на средах с сахарами потребность в нем отсутствовала.
По некоторым данным, бор также способствует росту и развитию грибов.
Существуют микроэлементы, которые сами по себе не необходимы, но влияют на усвоение других микроэлементов и могут частично заменить их или изменить направление обмена и нарушить баланс обменных процессов.
На фоне избытка необходимых микроэлементов они не влияют на рост, развитие и обмен, но при недостаточных дозах влияют очень сильно как в случае естественного недостатка их в природе, так и при дефиците, создаваемом действием многих неметаллических ингибиторов, таких, как СО, мышьяк, группы SH, CN и другие.
Приведем примеры известных микроэлементов - заменителей и конкурентов.
1. Ванадий способен частично заменять молибден при усвоении азота (у Azotobacter и Аnаbаеnа), но на фоне избытка молибдена юн не влияет (Насон, 1962).
2. Вольфрам, напротив, конкурирует с молибденом, уменьшая усвоение Мо при его дефиците и угнетая рост Azotobacter vinelandii (Килер, Вернер, 1962). Как конкурент молибдена известна также медь.
3. Уже упоминалось о способности кадмия заменять частично цинк, в частности в процессах биосинтеза триптофана и тирозина у Aspergillus niger (Bertrand, de Wolf, 1961).
4. Конкурентами содержащих магний ферментов часто проявляют себя кальций и стронций, конкурируя с магнием в фосфатазах и синтетазах. При пониженных дозах магния у грибов различных видов (Fusarium sporotrichiella, Trichothecium roseum, Aspergillus fumigatus, Fusella olivacea) стронций способствует торможению конденсации структурных единиц терпенов в цепи (каротиноиды) и циклизации их на стадиях С15 (фарнезол) или С30 (сквален), приводя к преимущественному образованию циклических спиртов (трихотеколон, фумигаллол) или стероидов (поин, фузеллин и т. д.) (Беккер, 1963).
Вопрос о сочетании и конкурентных отношениях микроэлементов в питании грибов важен как при использовании микроэлементов в сельском хозяйстве (микроудобрения), так и для микробиологической промышленности.
|
ПОИСК:
|
© GRIBOCHEK.SU, 2001-2019
При использовании материалов проекта активная ссылка обязательна:
http://gribochek.su/ 'Библиотека о грибах'
При использовании материалов проекта активная ссылка обязательна:
http://gribochek.su/ 'Библиотека о грибах'