
3. Окислительно-восстановительные ферменты и дыхательные цепи грибов
Реакции, производимые большинством из окислительно-восстановительных ферментов, являются крайне необходимыми для основного обмена грибов, поскольку они участвуют как в получении необходимой для синтетических процессов энергии, так и в подготовке исходных субстратов для этих синтезов, например, в форме восстановления нитратов или сульфатов. Вследствие их интимного участия в построении клеток они чаще бывают эндоэнзимами и имеются у всех грибов.
Окислительные энзимы делятся на: 1) дегидрогеназы, действующие по пути, установленному Виландом с отнятием от субстрата водорода, и 2) оксидазы, действующие, согласно теории Варбурга, через присоединение к субстрату кислорода. Однако это различие нельзя считать принципиальным, поскольку существуют дегидрогеназы, связывающие кислород, а роль большинства оксидаз сводится только к переносу электронов путем изменения валентности входящего в их состав металла. Кроме того, большинство из этих ферментов в восстановленном состоянии действуют как редуктазы (оксидоредуктазы).
Дегидрогеназы в большинстве случаев имеют в качестве коферментов или простетических групп никотинамид или флавины в форме НАД, НАДФ, ФМН или ФАД. В случае НАД-дегидрогеназ вторым кофактором большей частью бывает Zn2+, а вторым компонентом органической простетической группы - аденин, как в никотинадениндинуклеотиде. Аденин является также вторым компонентом флавинадениндинуклеотида.
Наилучшим образом изучены дегидрогеназы дрожжей и некоторых плесневых грибов, в особенности Aspergillus niger, Триозофосфатдегидрогеназы дрожжей и А. niger обычно содержат в качестве второго кофактора Zn2+, например, представляющая собой однокомпонентный белок глицеральдегид-3-фосфатдегидрогеназа, алкоголь - дегидрогеназа, фосфофруктокиназа и ряд других дегидрогеназ, участвующих в гликолитических путях ЭМП и ГМФЭ как альдолаза и 6-фосфоглюконатдегидрогеназа (Bertrand, de Wolf, 1958; Wacker et al., 1958). Необходимость цинка для действия этих энзимов доказывается подавлением активности фермента 1:10 фенантролином. При присоединении двух молекул ингибитора к одному атому Zn2+ энзим инактивируется необратимо. В алкогольдегидрогеназе одна молекула ферментного белка комбинируется с четырьмя атомами цинка. Содержащие цинк дегидрогеназы подавляются многими факторами, например, фенантролин связывает цинк, Р-хлормеркурбензоат и Ag2+ - активные SH-группы, мочевина - ферментный белок.
Участие в действии таких ферментов в качестве кофакторов НАД и НАДФ было доказано также с помощью гистохимических методов, основанных на образовании формазана из нитросинего тетразолия при инкубации с НАД или НАДФ и с соответствующим субстратом дрожжевых грибов Paracoccidioides brasiliensis и Saccharomyces cerevisiae (Reiss, 1967). В случае Saccharomyces cerevisiae исследовалось этим способом наличие НАДФ-пиридоксинфосфатдегидрогеназы, трансформирующей пиридоксинфосфат в пиридоксальфосфат. При этом помимо установления специфичности этой реакции путем подтверждения эффективности действия всех обнаруженных биохимическими методами ингибиторов (хлормеркурбензоат и антагонист пиридоксина 4-деоксипиридоксин-HCl) было отмечено отсутствие связи этого фермента с митохондриями. С помощью введения акцепторов электронов (дихлорфенолиндофенола или трифенилтетразолиумхлорида, ТТХ) было установлено наличие двух энзимов - НАДН2- дегидрогеназы и алкогольдегидрогеназы у базидиомицета Oudemansiella mucida, причем дегидрогеназа НАДН2 оказалась промежуточным переносчиком электронов в дыхательной цепи этого гриба. В случае окисления исходных субстратов с гидрофобными свойствами часто роль промежуточного переносчика переходит к НАДФН2-дегидрогеназе, для формирования которой необходимо присутствие фосфорилирующего НАД-энзима; НАД-киназы. Именно с формирования этого фермента начинается прорастание конидий Neurospora crassa, и максимум его накопления достигается уже через 30 мин от начала их инкубации в воде (Афанасьева и др., 1982).
В начале интенсивного вегетативного роста гриба, при потреблении углеводов, активность НАД-киназы сильно падает и снова нарастает при спаде интенсивности роста через сутки инкубации. С помощью электрофореза в полиакриламидном геле было обнаружено, что НАД-киназа у N. crassa присутствует в четырех формах субъединиц с разной молекулярной массой, из которых наиболее высокомолекулярные (I и II) характерны для конидий, а III форма с меньшей в 11,2 раза молекулярной массой преобладает в вегетативном мицелии (Афанасьева и др., 1982).
Дегидрогеназа, содержащая флавины, в частности глюкозооксидаза (β-D-глюкоза: О2-оксидоредуктаза), содержащая ФАД, была впервые обнаружена Мюллером в отпрессованном соке из Aspergillus niger еще в 1926 г. В дальнейшем она была установлена у А. oryzae, Penicillium notatum, P. chrysogenum, дрожжей и ряда других грибов (Андеркофлер, 19636). Этот фермент, окисляющий глюкозо-6-фосфат в 6-фосфоглюконат, наряду с 6-фосфоглюконатдегидрогеназой был найден также у различных видов Phytophthora (Clare, Zentneyer, 1966). Из других дегидрогеназ в прорастающих спорах Puccinia recondita обнаружена дегидрогеназа яблочной кислоты (Macko, Novacky, 1966), а в спорах грибов-трутовиков Trametes versicolor и Phellinus igniarius - флавин-содержащая ксилозооксидаза. К числу флавиновых дегидрогеназ относится также сукцинатдегидрогеиаза. Участие флавиновой системы в дыхательной цепи было также обнаружено у базидиомицета Oudemansiella mucida, а флавинсодержащие галактозооксидаза и глюкозооксидаза у Polystictus circinatus. Флавиновые энзимы О. mucida типа глюкозо-2-оксидазы оказались способными окислять моносахариды в соответствующие им гексозулозы, например D-арабино-2-гексозулозу (Vole et al., 1978, 1980).
Оксидазы не все способны самоокисляться с присоединением кислорода, как это должно быть исходя из теории Варбурга. Ферменты этого типа скорее можно обобщить, исходя из структуры их простетических групп, которые в подавляющем большинстве случаев представляют собой порфирины со строением тема, составленного из четырех пиррольных фрагментов (рис. 6.13). Азотные компоненты тема способны высвобождать валентности, могущие удерживать в центре этой структуры какой-либо металл. Примером типа такой структуры может служить строение протопорфирина IX (рис. 6.14). Наиболее типичны среди них цитохромы, содержащие железо, осуществляющее реакцию переноса электронов типа
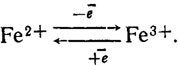
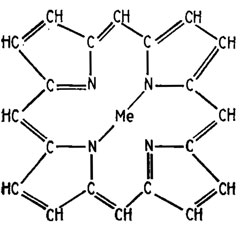
Рис. 6.13. Строение порфиринового ядра; Me - металл
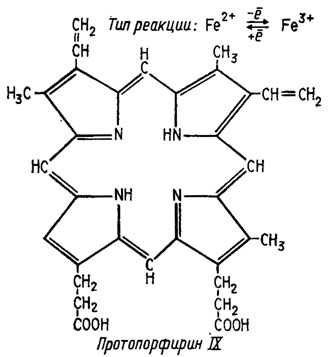
Рис. 6.14. Строение протопорфина IX и тип реакции гемовых ферментов
Биосинтез порфиринов (рис. 6.15) исходит из глицина и сукцинилкоэнзима А, причем при декарбоксилировании и отнятии воды на первом этапе получается 8-аминолевулиновая кислота. При дальнейшей циклизации получается порфобилиноген, из четырех фрагментов которого формируется уропорфирин III. Четвертый этап биосинтеза состоит в потере уропорфирином III четырех молекул СО2 с трансформацией его в копропорфириноген III, который, теряя еще две молекулы СО2 и окисляясь, превращается в протопорфириноген IХ. Дальнейшее его окисление с потерей четырех атомов водорода приводит к образованию протопорфирина IХ.
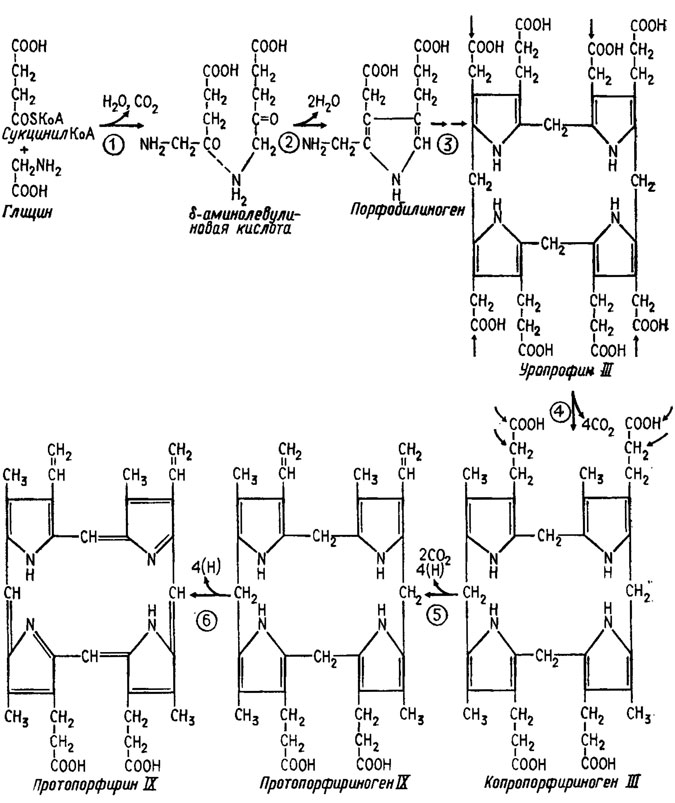
Рис. 6.15. Биосинтез порфирииов (Девис и др., 1966)
У головневых грибов в синтезе цитохромов, видимо, принимает участие цинк, что видно на примере Ustilago sphaerogena, резко повышающего продукцию цитохрома в присутствии повышенных доз цинка. То, что цинк участвует при этом в синтезе белкового компонента энзима, можно видеть из результатов внесения одновременно с цинком специфичного ингибитора и-РНК актиномицина D, который полностью подавляет синтез цитохрома у Ustilago sphaerogena (Brown et al., 1966). Наиболее подробно цитохромы изучались у дрожжей, однако с помощью спектрофотометрии они также были обнаружены у очень большого ряда гифообразующих грибов из всех классов (Lindenmayer, 1965).
В настоящее время у грибов известно восемь видов оксидаз со строением цитохромов, относящихся к трем из четырех известных типов структур этих ферментов. У них встречаются цитохромы а, а1, а3, b, b1, b2, с и с1. Не обнаружен у грибов только встречающийся у бактерий цитохром типа d.
Большая часть этих энзимов участвует в переносе электронов в дыхательной цепи, и только два из них (a1 и b1) образуются в анаэробных условиях. Цитохром 62 отличается от всех других цитохромов тем, что он постоянно связан с ДНК, состоящей из 30 нуклеотидов, потеря которой, однако же, не влияет на активность фермента. Функции этого цитохрома состоят в специфическом окислении лактата и других оксикислот.
У грибов известен также не вошедший в сводку Линденмейера цитохром Р-450, окисляющий алканы и другие липиды через монооксигеназную микросомальную систему, содержащую кроме цитохрома Р-450 еще НАДФН2, цитохром Р-450-редуктазу и фосфолипидный компонент (Мауэрсбергер, Матяшова, 1980). Она формируется при росте на n-алканах как единственном источнике углерода и энергии у Candida tropicalis, С. guillermondii, Torulopsis Candida, участвуя в окислении алканов и жирных кислот. При достижении стадии торможения роста дрожжей концентрация цитохрома Р-450 в их клетках значительно снижается. Этот фермент является адаптивным, специфически формирующимся при росте дрожжей на средах с гексадеканом, пальмитиновой кислотой или при использовании эндогенных липидов после исчерпания источника углерода при росте на среде с глюкозой (Ильченко и др., 1980), что было установлено при исследовании культур Candida lipolytica, С. tropicalis, С. utilis, С. guillermondii и Torulopsis Candida Оксигеназиая система, включающая цитохром Р-450 и НАДФН, подавляется оксидом углерода (II), но является цианидрезистентной и нуждается в наличии молекулярного кислорода, предпочтительнее использует алканы со средней длиной цепи, окисляя их сначала в соответствующие алкоголи (и гидроксипроизводные) и альдегиды, а потом в жирные кислоты (Weete, 1980). Пигмент гемопротеин Р-450 был впервые открыт у Saccharomyces cerevisiae в корпускулярной фракции гомогената его клеток.
Путь окисления алканов при посредстве цитохрома Р-450 показан в табл. 6.8. Субстратспецифичные оксигеназы грибов, функционирующие с помощью цитохрома Р-450, изучались в течение последнего десятилетия довольно интенсивно как в целях использования грибов для переработки различного типа углеводородов, так и в целях трансформации стероидов при изготовлении лечебных препаратов типа кортизона. Одним из ранних исследований этой категории было обнаружение у Aspergillus niger железозависимой антранилатгидроксилазы, производящей двойное гидроксилированце антраниловой кислоты, но теряющей эту активность при росте гриба на среде с дефицитом железа или в присутствии о-фенантролнна. Фермент реактивировался в присутствии ферриэтилендиаминтетрауксусной кислоты (Fе2+-ЭДТА) илн феррицитрата (Kumar et al., 1973). Позднее у гриба Acremonium sp. была обнаружена НАДФН-зависимая оксигеназа сходного типа, окисляющая этан сначала до этанола, а потом до ацетальдегида и соответствующей кислоты (Davies et al., 1976). Сходство этой оксигеназы с оксигеназой на основе цитохрома Р-450 состояло в том, что в бесклеточном гомогенате она оказалась связанной с фракцией микросом. Однако испытание ее СО-спектра поглощения не дало характерных для цитохрома Р-450 результатов.
Таблица 6.8. Схема окисления n-октана Candida lipolytica при участии цитохрома Р-450 (Weete, 1980)
Способность производить гидроксилирование ароматических углеводородов свойственна мукоровому грибу Cuntnghamella bainieri, причем связанный с этим окислением фермент содержит цитохром Р-450. Фермент НАДФН-зависимый, теряет активность в присутствии типичных для Р-450 ингибиторов (СО, SKF-525A и метирапон), имеет оптимальный рН 7,8 и обладает цианидрезистентностью. Кроме того, он связан с микросомной фракцией и его принадлежность к оксигеназам на основе цитохрома Р-450 подтвердилась его отношением к металлам (например, подавление активности Fe3+ и стимуляция ее Fe2+/Ferris et al., 1976).
Гидроксилирование с помощью грибов стероидов и другие их трансформации, например, связанные с формированием двойных связей в кольце, также производились, причем преимущественно с применением грибов из числа дейтеромицетов. Способен производить эти трансформации и ряд базидиальных грибов, например, гидроксилирование в положениях 2-β, 7-а, 7-α, 11-α, а также восстановление кетоформ в позициях 20-β в гидроксильную форму. Производить трансформации 3-β-гидрокси-5-андростен-17-она оказался способным базидиальный гриб-дереворазрушитель Pleurotus ostreatus (Thoa et al., 1978). Некоторые виды грибов способны производить и обратные реакции, приводящие к восстановлению окисленных форм гидроксисоединений. Такая реакция, производимая гидроксипируватредуктазой, была обнаружена у Aspergillus niger.
Уже давно было установлено, что цитохромная дыхательная цепь грибов, исключая микросомальные оксигеназы, связанные с цитохромом Р-450, находится в митохондриях. Первоначальные исследования цитохромов грибов проводились спектроскопически на неразрушенном мицелии или на нефракционированном его гомгенате. Из исследованных 45 видов грибов все содержали цитохромы типов а, b и с и цитохромоксидазу (а3), хотя некоторые из них показывали отличия друг от друга в деталях спектров поглощения.
Позднее исследовалась фракция отмытых при центрифугировании при 10000×g митохондрий базидиомицета Schizophyllum commune, как нативных, так и в присутствии различных ингибиторов (Niederpruem, Hachett, 1961). Дыхание митохондрий ингибировалось соответственно 97, 95 и 85%-м фенилмеркурацетатом, антимицином А, блокирующим дыхательную цепь на уровне перехода между цитохромом b и с и блокирующими цитохром аз цианидом и азидом, а также высокими концентрациями (порядка 10-3-10-4) динитрофенола, разобщающего окисление с фосфорилированием. Митохондрии S. commune окисляли НАДН особенно в присутствии цитохрома с, восстанавливающегося при включении в систему цианида. Этими и другими тестами было показано наличие в митохондриях цитохромов b, с и а-а3, подтверждаемое не только подавлением системы цианидом, но и реакцией подавления дыхания в темноте оксидом углерода (II). В митохондриях S. commune выявлены также сукцинатцитохром с редуктазная, цитохром с, НАДН- и сукцинатоксидазная и цитохром а оксидазная системы. Расчет на основе спектрофотометрических измерений показал четко эквимолярные концентрации в митохондриях а, b и с типов цитохромов.
Исследовался также дифференциальный спектр (при - 196°С) фракции митохондрий Agaricus campestris var. bispora (Gallinet, 1974, 1976), показавший, что в них содержатся цитохромы а-а3 и, по-видимому, не менее трех цитохромов с пиками поглощения при 552, 557 и 562 нм, а также цитохромы с и c1. Соотношения цитохромов типов а, b и с были равны 1,0:1,5:2,0 соответственно. Сопоставление этих данных с соответственными расчетами для других видов грибов показывает близкие соотношения цитохромов только у Aspergillus niger, тогда как у дрожжей Saccharomyces carlsbergiensis и Neurospora они увеличиваются для цитохромов b и с более прогрессивно (табл. 6.9).
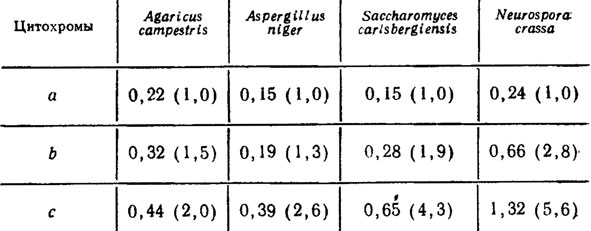
Таблица 6.9. Подсчет концентраций трех типов цитохромов, определяющих их стехиометрию у разных видов грибов (Gallinet, 1974), нмоль/мг белка
Исследование кинетики восстановления цитохромов Agaricus campestris показало, что у него присутствуют только два цитохрома типа b, которые восстанавливаются в присутствии сукцината, с пиками поглощения при 559 и 562 нм, обнаруживаемые при температуре жидкого азота (-196°С).
Цепь переноса водорода (или электронов), т. е. дыхательная цепь в полном ее виде, включает еще и другие компоненты, а именно ферредоксины и коэнзим Q. Ферредоксины или железо-серопротеины мало изучены в отношении их структуры. Известно, что они включаются в митохондриальный перенос электронов в тесном сочетании с флавиновыми энзимами в процессе их контакта с пиридиновыми дегидрогеназами. В их составе имеется различное количество (от двух до семи атомов) негемового железа и такое же количество лабильных сульфгидрильных групп, освобождающихся в виде H2S при подкислении. Подробнее изучены ферредоксины - участвующий в фотосинтезе хлоропластов шпината и в усвоении атмосферного азота, выделенный из анаэробного микроба Clostridium pasterianum (Ленинджер, 1974), но считается, что они есть и у грибов (Lyr et al., 1975).
Коэнзим Q относится к числу хинонов, формирующихся в шунте терпенов (рис. 6.16) и совершенно несходных по структуре с цитохромами. К ним относятся обнаруживаемые у грибов убихиноны и убихроменолы.
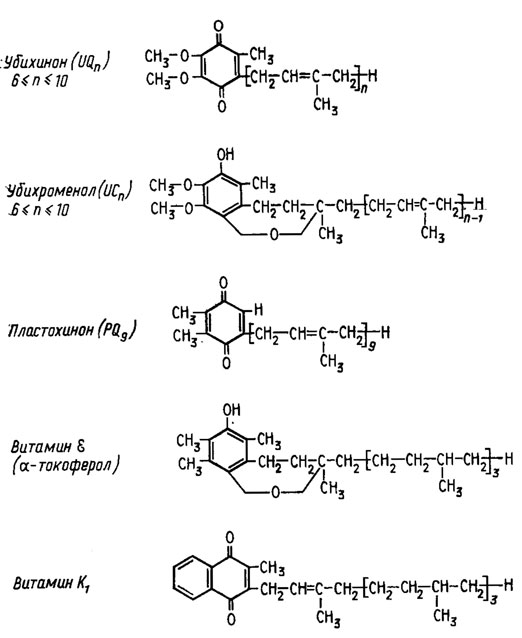
Рис. 6.16. Строение хинонов, участвующих в транспорте электронов в дыхательной цепи
Убихиноны различного строения обнаружены сейчас у значительного числа грибов, как дрожжевых, так и гифообразующих из классов сумчатых, базидиальных и несовершенных грибов (Lindenmayer, 1965). Образуются они как в анаэробных, так и в аэробных условиях, и установлено их место в дыхательной цепи между флавинами в сочетании с ферредоксинами и цитохромом b (Ленинджер, 1974).
Расположение упоминавшихся выше ферментов в дыхательной цепи и связь ее с метаболитами цикла трикарбоновых кислот приведены на рис. 6.17. Оно слагается из последовательности: НАД → флавопротеид (ФМН) → кофермент Q (убихинон) → цитохром b → цитохром с (или с1-с) → цитохром а → кислород воздуха. Конечным продуктом реакции является вода.
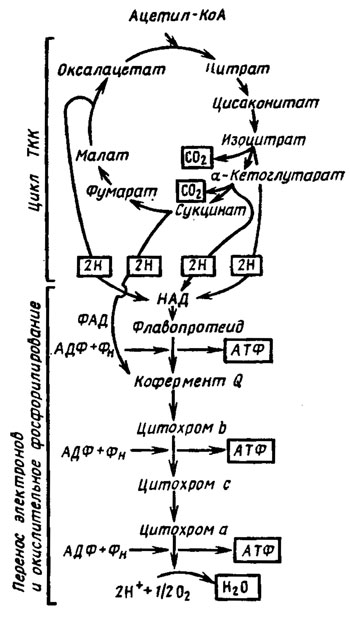
Рис. 6.17. Схема дыхательной цепи и окислительного фосфоргилирования. Конечные продукты стадий в рамке (Ленинджер, 1974)
Параллельно существует также система, начинающаяся с флавиновой сукцинатдегидрогеназы (кофермент ФАД), субстрат сукцинил-КоА, переносящая электроны прямо на убихинон. Сходный процесс претерпевают продукты распада жиров - глицерофосфат и ацилированные КоА производные жирных кислот (рис. 6.18). Путь переноса электронов через НАД возможен с изоцитрата, малата и пирувата, также с глутамата и различных 3-оксиацилпроизводных КоА. На трех этапах дыхательной цепи может происходить сопряжение окисления с фосфорилированием (образованием АТФ), а именно между ФМН и KoQ, цитохромами b и с, цитохромом а и кислородом воздуха, где это позволяет высокая разность энергетических потенциалов перехода коэнзимов (Е0').
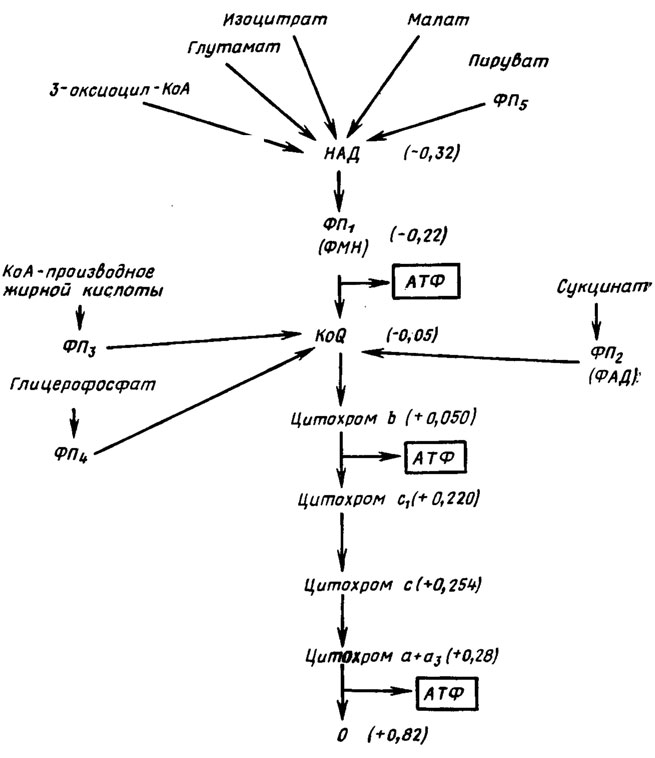
Рис. 6.18. Места вхождения электронов от различных субстратов в дыхательную цепь и места окислительного фосфорилнрования: ФП - флавопротеины; в скобках уровни E0', V (Ленннджер, 1974)
Альтернативные дыхательные цепи грибов. Истинное место убихинона (коэнзима Q) в дыхательной цепи грибов вскрылось в связи с исследованиями в области механизма действия различных ингибиторов дыхания (рис. 6.19). Обнаруженные ранее альтернативные пути переноса протонов (двух атомов водорода) - первый через НАД→флавинмононуклеотид (ФМН) и негемовое железо (ферредоксин) (I), второй через сукцинат→флавинадениндинуклеотид (ФАД) и другой железосеропротеин (II) - оказались сходящимися. Место их соединения - это этап цепи переноса, занятый коэнзимом Q, с которого осуществляется передача заряда на цитохром.
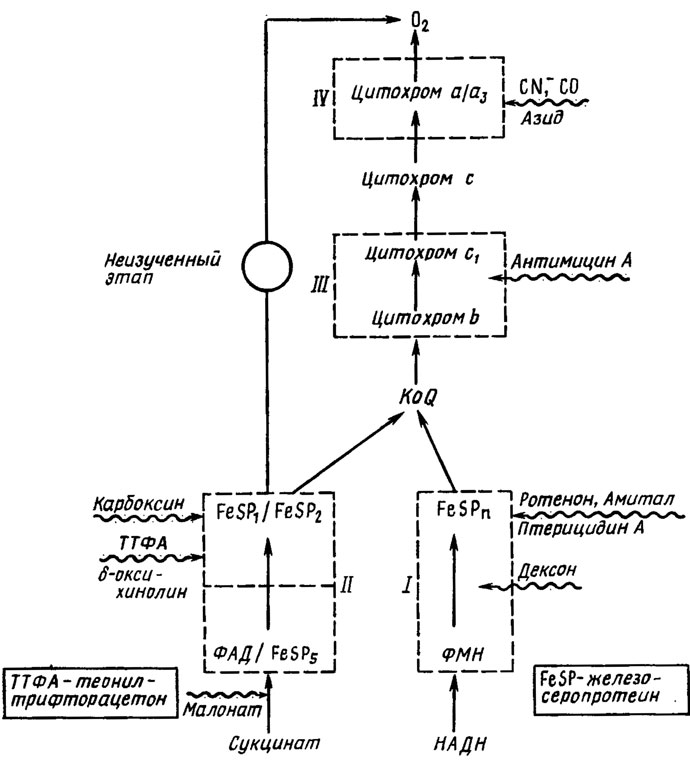
Рис. 6.19. Схема главной и альтернативной дыхательной цепи грибов и болокирующих различные этапы ингибиторов. Места действия ингибиторов указаны стрелками с волнистой чертой (Lyr et al., 1975)
Блокирование цианидом, оксидом углерода (II) или азидом этапа цитохрома а + цитохромоксидаза (цитохром а3) приводит к прерыванию перехода от окисленного состояния к восстановленному и обратно всех компонентов цепочки цитохромов, что на модели клеток животных дает в результате полное прекращение дыхания. Однако у целого ряда нечувствительных к цианиду грибов дыхание при этом не прекращается, причем даже тогда, когда блокируется с помощью ротенона, дексона или амитала начальный этап цепи I через НАД и ФМН. Блокировка антимицином А перехода от цитохрома b к цитохрому c может в этом случае привести даже к стимуляции дыхания. Полное прекращение дыхания достигается только при одновременном с цитохромами блокировании карбоксином, теонилтрифторацетатом (ТТФА) или 8-оксихинолином этапов пути II через сукцинат, ФАД и железосеропротеин. При блоке одних этапов цитохромов дыхание значительно усиливается, не уступая нормальному в контроле (Lyr et al., 1975). Это прямо указывает на наличие альтернативного пути дыхания с усвоением кислорода через иные, чем цитохромы, пока еще не изученные акцепторы. Заблокировать этот путь можно только малонатом или веществами, воздействующими на ферредоксиновый компонент цепи II, как карбоксин, 8-оксихинолин и ТТФА (см рис. 6.19).
На следующем этапе этого альтернативного пути могли бы. возможно, оказаться, например, меланины с их способностью и аутоокислению и восстановлению, хотя до настоящего времени их окисление считается свободным, не связанным с способностью к фосфорилированию. Это в определенной степени поддерживается значительно меньшей потребностью меланинсодержащих форм в кислороде при их дыхании (Жданова, 1976) и цианидрезистентностью при чувствительности к блокаде цепи II окисления темно-окрашенных грибов как Trametes versicolor, Ustilago maydis, виды аскомицетов из порядков Helottales и Sordariales (Lyr et al., 1975). Исключение составляет краснопигментная, но цианидорезистентная Rhodotorula mucilaginosa.
Наличие у грибов альтернативных путей дыхания имеет принципиальное значение для отбора системных веществ, применяемых для борьбы с болезнями растений. Были проведены обширные эксперименты на дрожжевых грибах из родов Torulopsis и Candida, показавшие, что количество альтернативных путей переноса электронов в дыхательной цепи грибов, видимо, достигает значительного числа вариантов. Только у одного Torulopsis Candida, по мнению исследователей, их намечается не меньше четырех (Ильченко, Соколов, 1980). Прежде всего были замечены различия в первых ступенях цепи переноса, заключающиеся в замене блокируемого цианидом обычного пути электронного транспорта цианид-резистентным, формирующимся при росте на нормальных алканах, сопровождаясь продукцией цитохрома Р-450, участвующего в их гидроксилировании до алканолов (рис. 6.20). При росте на глюкозе цитохром Р-450 не появлялся до ее полного исчерпания (Ильченко и др., 1980).
Метаболизм n-алканов (а также, видимо, ряда жирных кислот и липидов), как выяснилось из опытов с ингибиторами, протекает на базе микросомальной фракции цитоплазмы (Ильченко, Соколов, 1980) при участии НАДФ и цитохром-Р-450-редуктазы. Он ингибируется, сходно с подавлением ингибиторами микросомальной оксигеназы, СКФ-525А, метирапоном и бензогидроксамовой кислотой (БГК). Эта система была обнаружена кроме Torylopsis Candida еще у трех видов Candida (С. guillermondii, С. tropicalis и С. lipolytica/Мaуepcбepгep, Матяшова, 1980), которые все были способны утилизировать для роста n-алканы, и отсутствовала у не растущих на этом субстрате видов.
Помимо этой системы, связанной с цианидрезистентным путем, блокируемым БГК (Ильченко, Соколов, 1989), по-видимому, имеется второй устойчивый к цианиду путь переноса электронов, где конечное окисление осуществляется за счет перекиси водорода при участии цитохром-с-пероксидазы. Схематическое изображение описанных путей переноса электронов у Torulopsis Candida приведено на рис. 6.20.
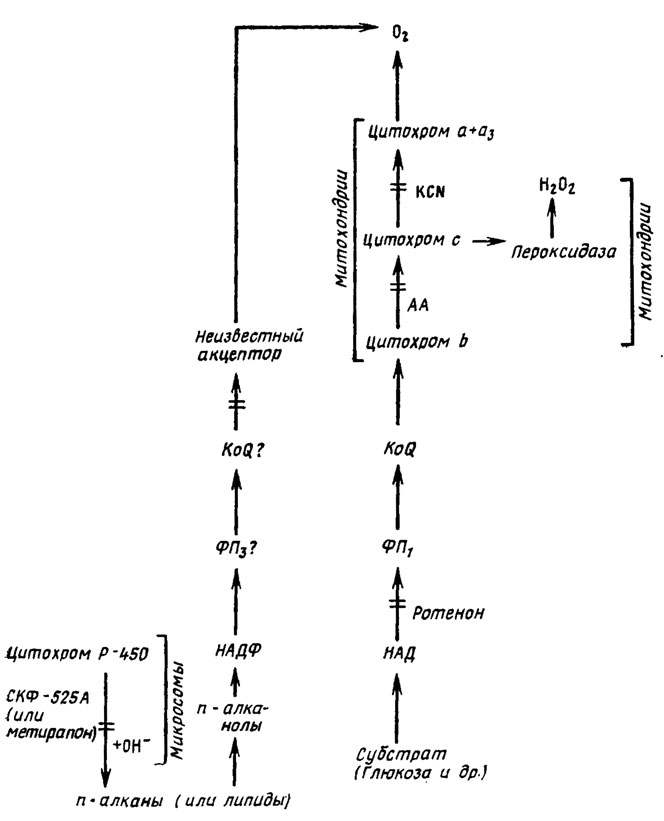
Рис. 6.20. Предположительная схема альтернативных путей переноса электронов у Torulopsis Candida и других дрожжей из рода Candida в зависимости от состава среды и фазы роста: БГК - бензогидроксамовая кислота; АА - аитимиции А (Ильченко, Соколов, 1980)
Среди других альтернативных путей дыхания грибов известно наличие цианидрезистентного митохондриального пути окисления у прообразующих грибов, например у Moniliella tomentosa. У этого гриба такое дыхание возникает под влиянием нормальных пропанола и бутанола, тогда как метанол и этанол не способны его индуцировать. Причина индукции цианидрезистентного дыхания заключается в способности С3 и С4 алкоголей интерферировать с окислительным фосфорилированием, что приводит к снижению роста и накоплению этилового спирта (Venderleyden et aL, 1978).
Цианидрезистентность дыхания была также обнаружена у грибов Fusarium sambucinum (Акименко и др., 1981) и Fusidium toccineum (syn. Acremonium fusidioides Gams/Телеснина и др., 1980), изучавшихся в связи с образованием ими антибиотиков энниатина и фузидиевой кислоты. Эксперименты проводились на фоне исследования ингибиторов дыхания. У Fusudium энергообеспечение, способствующее росту биомассы, связано в основном с окислительным фосфорилированием, локализованным в митохондриях, и с дыхательной цепью с включением цитохромов. Введение ингибирующего синтез ферментов этой цепи хлорамфеникола переводило активного продуцента фузидиевой кислоты полностью на цианидрезистентный путь дыхания, и выход антибиотика на единицу биомассы повышался в три раза. Наоборот, при ингибировании цианидрезистентного дыхания салицилгидроксаматом он снижался в 4,5 раза. По этим данным, а также по нарастанию интенсивности цианидрезистентности от неактивных штаммов к обильно продуцирующим антибиотик (в конце ферментации от 15-16% до 90-100% от полной дыхательной активности) можно было вывести заключение, что синтез данного антибиотика тесно связан с ингибируемым гидроксаматами путем свободного окисления, возможно, ароматических веществ, в котором, например, формируются меланины.
В случае биосинтеза антибиотика рода Fusarium, энниатина, сходное исследование привело к несколько иным результатам (Акименко и др., 1981). Интенсивность синтеза энниатина связана потреблением пула АТФ, которое более выражено в период усиленного роста и менее явно в стационарной фазе, в период наиболее активного синтеза антибиотика. Соответственно у активного продуцента переход в конце ферментации на цианидрезистентное дыхание был менее выражен, чем у неактивного. И то и другое говорит о более, чем в случае фузидиевой кислоты, интенсивной связи биосинтеза энниатина с энергетическим обменом и синтезом новых ферментных систем, в частности связанных с затратой энергии гидролиза АТФ.
Авторы указанной работы считают, что цианидрезистентное дыхание, так же как и сверхсинтез метаболитов (например, лимонной кислоты), является вариантом сброса избыточной свободной энергии в случае цианидрезистентного дыхания, протекающего на уровне коэнзима Q в дыхательной цепи. Однако скорее все же можно считать, что синтез лимонной кислоты (или например, этанола) нельзя причислять только к футильным ("бесполезным") циклам, существующим исключительно для сброса лишней энергии, так как эти продукты легко используются в основном обмене. То же касается и близкой по структуре к стеролам и меланинам фузидиевой кислоты. Меланины, как и стеролы, помимо других функций используются в обмене, о чем говорит поддержка ими жизнедеятельности и синтезов, их окисление в процессе дыхания и включение в них не только кислорода, но и меченной изотопам углекислоты. Судя по согласованности эффекта гидроксаматов в отношении синтеза меланинов (Жданова, 1976) и цианидрезистентного дыхания (Телеснина и др., 1980; Акименко и др., 1981), их формирование должно идти именно при участии этого энергодающего процесса на базе полифенолоксидаз. В пользу последней гипотезы в некоторой степени говорят также исследования группы авторов (Трутко и др., 1980) по влиянию на цианидрезистентное дыхание Candida lipolytica дефицита ряда микроэлементов.
Несмотря на сильное угнетающее влияние дефицита железа на синтез всех цитохромов (включая и цитохром с и его пероксидазу), цианидрезистентное дыхание не угнетается, а даже стимулируется при его дефиците у данного организма. Правда, ускорение появления цианидрезистентного пути в дыхательном метаболизме С. lipolytica наблюдается также и при дефиците меди, вследствие чего вопрос о возможной природе цианидрезистентных оксидаз этого организма остается пока в значительной мере открытым.
Полифенолоксидаза. К числу полифенолоксидаз, важных для некоторых путей окисления и формирования меланинов, ранее относили две категории: собственно полифенолоксидазы, или лакказы, окисляющие фенолы, и тирозиназу, окисляющую азотсодержащие соединения с бензольным кольцом, например тирозин или фенилаланин. Сейчас эти ферменты считают за единую группу. Ферменты этого типа, видимо, имеют строение гемов, однако к противоположность цитохромам в их состав входит не железо, а обычно закисная медь. Поэтому грибы, образующие обильно тирозиназу, нуждаются в повышенных дозах меди и могут иногда добывать ее из медьсодержащих фунгицидов. Железо и марганец могут выступать как конкуренты и ингибиторы лакказы.
Лакказой, окисляющей такие соединения, как перокатехин, гидрохинон, резорцин, бензидин и т. п. в соответствующие хиноны,. обладает большинство грибов - дереворазрушающих базидиомицетов, например Oudemansiella mucida, Polyporus versicolor, Polyporus zonatus, Collybia velutipes, Psalliota bispora. У всех этих грибов лакказа выделяется в окружающую среду, почему они все дают реакцию Бавендамма на посинение введенной в среду гваяколовой кислоты (Lyr, 1958). Эта реакция отсутствует у возбудителей буровой гнили древесины, как. Coniophora cerebella (С. puteana), Lentinus squamosus или Daedalea quercina. Их считали ранее неспособными образовывать полифенолоксидазы, однако в настоящее время выявилось, что многие из них, в частности возбудители бурой гнили из родов Polyporus и Coniophora, имеют внутриклеточную полифенолоксидазу, которую они не способны выделять в окружающую среду. В частности, это касается Coniophora puteana (Rosch, 1966).
Среди грибов - возбудителей белой гнили - продуценты внеклеточной лакказы встречаются очень часто, а среди обследованных Люром 103 видов дереворазрушителей их оказалось 47% (Lyr, Ziegler, 1959). Из Polyporus versicolor был получен и охарактеризован гомогенный препарат лакказы, которую он продуцирует очень обильно. Стимуляторами полифенолоксидазы оказались органические растворители, например 50%-й алкоголь, предположительно способствующий диссоциации требуемого для действия энзима компонента. Ингибиторами лакказы и, видимо, естественными ее регуляторами являются нуклеиновые кислоты, как РНК, так и ДНК, а также другие соединения пуринов. Предположительно они связывают входящую в состав фермента медь, а также и белковый компонент фермента. Лакказа Polyporus versicolor и P. zonatus оказалась эффективной в пределах рН от 3,0 до 6,5 с оптимумом действия при рН 5,0 и продукция ее специфически увеличивалась в 60 раз при введении в культуральную среду 33 мг/л йодида калия (Lindenberg, Fahreus, 1952).
Функция внеклеточной лакказы дереворазрушающих грибов начала разъясняться на модели грибов - возбудителей белой гнили древесины - в связи с выявлением роли фенолоксидазной системы в разрушении лигнина, сопряженной с целлюлозоразрушающей способностью этих грибов. Оказалось, что активность целлюлаз при разложении древесины до конечного продукта, целлобиозы, тесно связана с образованием фенолоксидазами хинонов и феноксирадикалов через действие энзима целлобиозохиноноксидоредуктазы (Westermark, Eriksson, 1974). Это было показано на примере такого вида гриба - возбудителя белой гнили древесины, как Sporotrichum pulvirulentum, являющегося несовершенной стадией базидиомицета Phanerochaete chrysosporum. Окислительно-восстановительная система этого гриба (типа лакказы) играет регулирующую роль в комплексных процессах разложения грибами лигнина и целлюлозы. Это было доказано тем, что мутант этого триба с дефицитом фенолоксидазы оказался способным разрушать лигнин только при добавке в его культуру лакказы (Ander, Eriksson, 1976). Механизм этой регулирующей функции, изученный на примере гриба Pleurotus ostreatus, состоит, видимо, в том, что промежуточный продукт разложения целлюлозы - целлобиоза окисляется с помощью дегидрогеназ (целлобиозохиноноксидоредуктаз) с восстановлением хинона в феноксирадикал, возникающий при деградации лигнина, заканчивающейся полимеризацией феноксирадикала и образованием меланина. Таким образом, целлюлозоразрушающая и лигнинразрушающая способности грибов оказываются тесно взаимосвязанными и взаимно регулирующими друг друга (Hiroi, Eriksson, 1976).
Лакказа считалась неспособной окислять ароматические аминокислоты типа тирозина или фенилаланина. Эту способность приписывали другому, близкому к ней по свойствам ферменту - тирозиназе. Однако сейчас большей частью эти два фермента считают идентичными. Тирозиназа также содержит в качестве кофермента медь, что доказывается реактивацией ее ионами Сu2+ при подавлении синильной кислотой.
Тирозиназа, играющая большую роль в обмене животных при образовании дигидроксифеиилаланина (ДОФА), предшественника гормонов надпочечников адреналина и норадреналина, очень распространена и у грибов микоризообразователей, таких как виды Boletus и Lactarius. Мякоти их плодовых тел свойственно синеть на изломе (у подосиновика, Boletus luridus, груздя, белянки и других видов Lactarius). Также синеет она у шампиньона.
Тирозиназа бывает как внеклеточной, выделяющейся в среду, так и внутриклеточной, причем последняя была обнаружена у ряда дереворазрушающих грибов, как Polyporus schweinitzli и P. sulphureus (Rosch, 1966). Роль ее у грибов, вероятно, в некоторых чертах сходна с ее ролью у животных, у которых продукты, образующиеся при действии тирозиназы (адреналин и норадреналин), принимают большое участие в явлениях проницаемости и гомеостаза.
Поскольку регуляция проницаемости мембран особенно сильно должна влиять на питание паразитных и микоризообразующих грибов, наблюдаемое обилие у них тирозиназы должно согласовываться с этой точкой зрения. Другим доказательством ее правильности является способность грибной тирозиназы образовывать из L-тирозина или фенилаланина в присутствии аскорбиновой кислоты дигидроксифенилаланин (ДОФА) - предшественник адреналина животных. Продуктом дальнейшего действия тирозиназы на ДОФА или окисленные производные индола оказываются конденсированные, соединения, укрупнение молекул которых ведет к образованию темного пигмента меланина и выявляется в форме-посинения мякоти плодовых тел на изломе. Сходным образом протекает меланиногенез у животных.
Другой тип меланинов, не содержащих азота, например у Daldinia concentrica, образуется возможно уже при участии лакказы; из продуктов конденсации соединений типа стероидов или фенантрена. Однако такие меланины у грибов более редки, а чаще у них обнаруживаются азотсодержащие, сформированные из фрагментов ДОФА или индола. Приписываемая меланинам экологическая: роль состоит во всесторонней защите от повреждений в экстремальных условиях обитания, включая солнечную, особенно ультрафиолетовую радиацию, низкие и высокие температуры, сухость воздуха и субстрата. Защитный эффект меланина, по мнению автора этой гипотезы (Н. Н. Ждановой), неспецифичен и сводится к поддержанию нормального для грибной клетки уровня окислительно-восстановительного режима, рН и ионной силы, смещающихся под влиянием экстремальных воздействий (Жданова, 1976).
Пероксидаза и каталаза. Среди оксидаз порфиринового типа, связанных как с кофактором с трехвалентным железом (Fe3+), у грибов также обильно встречаются пероксидаза и каталаза. Первая из них отщепляет кислород от органических перекисей, а вторая расщепляет перекись водорода с образованием атомарного кислорода и воды. Отличие этих ферментов от цитохромок заключается в том, что они не окисляют, а восстанавливают перекиси, вследствие чего их активная форма не восстановленная, а окисленная и функционирует соответственно реакции: Fe3+→Fe2+, а производимая ферментом трансформация субстрата выглядит подобно реакции: Н2О2→Н2О + О (Lindenmayer, 1965). Обa этих фермента широко распространены у грибов. Каталаза была обнаружена у Penicillium chrysogenum, Aspergillus niger, Myrothecium verrucaria, Caldariomyces fumago (Shaw, Hager,1961), у которого она участвует в системе окислительного хлорирования β-кетоадипиновой кислоты и у базидиомицета Oudemansiella mucida. Участвует она и в системе окисления глюкозо-6-фосфата в 6-фосфоглюконат у А. niger и других плесневых грибов (Андеркофлер, 19636). Пероксидаза, видимо, очень характерна для дереворазрушающих грибов из категории разрушителей ядровой древесины. Среди изученных Люром 103 видов грибов-дереворазрушителей образующими пероксидазу оказалось только 12%, против 47%, образующих лакказу, и все они относились к разрушителям ядра древесины дуба или сосны.
Отсюда возникает предположение, что окисление циклических компонентов лигнина, разрушителями которого являются эти виды, зависит от наличия у них пероксидазы.
Особенно много пероксидазы оказалось у видов из рода Phellinus, в частности у Phellinus igniarius (Lyr, 1959), Грибная пероксидаза оказалась сходной с лакказой по их отношению к температуре, хотя и близкой по другим свойствам к растительной пероксидазе. Например, у нее очень близкий к растительной пероксидазе оптимальный рН (5,0-6,3) и температурный коэффициент Q10 (повышение активности при увеличении температуры на 10°), "близкий к 2,0. Реакция ускоряется три таком коэффициенте до 50%, но, вообще, термостабильность энзима зависит от вида гриба, например, у Phellinus robustus энзим инактивируется на 50% при 77°С, а у Forties annosus при 60°С. Этанол в концентрации 4% инактивирует энзим.
Каталаза и пероксидаза обильно накапливаются в мицелии Penicillium chrysogenum в процессе ферментации пенициллина, но главным образом внутриклеточно, а в среду выходят только в конце роста в начале автолиза клеток мицелия (Маттисон, 1956).
При анализе пероксидазной активности у грибов дейтеромицетов, живущих на опавших листьях и на хвойном опаде, оказалось, что от 30 до 60% из их числа обладают этой способностью, особенно при выращивании их на субстратах пероксидазного окисления, таких как таннин, галловая кислота, пирогаллол, аскорбат или отвар дубовой коры. Те же виды почвенного происхождения обладали этой способностью не более чем в 1,6% случаев (Борисова, Двойное, 1972). К числу видов грибов, обладающих высокой пероксидазной активностью, относились виды рода Cladosporium (С. gossypicola, С. transchelii, С. ovorum) и Botrytis cinerea, особенно активные при выращивании на средах с отварами из листьев березы и дуба.
Из других пероксидаз грибов можно назвать хлорпероксидазу, обнаруженную у Caldariomyces fumago, которая осуществляет трансформацию β-кетоадипиновой кислоты в δ-хлорлевулиновую кислоту (Shaw, Hager, 1961). Однако этот процесс, оптимизирующийся при очень низких уровнях рН (рН 2,8), происходит многоэтапно, причем хлоропероксидазой осуществляется только последний этап - окисление с замещением кислорода хлором. В предшествующих этапах этой реакции, которая возможна только в присутствии всех компонентов комплекса, принимают участие: гидролаза, выщепляющая глюкозу из запасных полисахаридов, клетки; глюкозооксидаза, окисляющая эту глюкозу до глюконовой кислоты; каталаза, расщепляющая выделяющуюся при окислении глюкозы перекись водорода на воду и кислород, который в момент выделения с помощью хлорпероксидазы реализует использование хлор-иона для хлорирования β-кетоадипата (Shaw, Hager, 1961).
|
ПОИСК:
|
© GRIBOCHEK.SU, 2001-2019
При использовании материалов проекта активная ссылка обязательна:
http://gribochek.su/ 'Библиотека о грибах'
При использовании материалов проекта активная ссылка обязательна:
http://gribochek.su/ 'Библиотека о грибах'